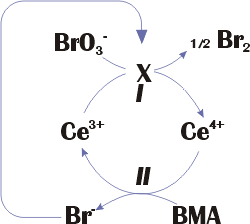
Рис. 13. Схема реакции Белоусова –
Жаботинского. Пространственно-временные режимы, предсказанные в моделях типа
реакция-диффузия можно наблюдать на химических моделях. Самой знаменитой из них
является реакция, которую в 1958 г. описал русский химик Белоусов - окисление
лимонной кислоты броматом калия, катализируемое ионной парой Се4+ - Се3+. Изучение этой реакции было
продолжено Жаботинским (1964), который показал, что в
качестве катализатора вместо церия можно применять марганец и железо, а в
качестве восстановителя вместо лимонной кислоты - использовать ряд органических
соединений, либо имеющих метиленовую группу, либо образующих ее при окислении. К
таким соединениям относятся малоновая и броммалоновая кислоты. Обычно реакция
проводят при 25 С в сернокислом растворе смеси бромата калия, малоновой и
броммалоновой кислот и сернокислого церия. Экспериментальному и модельному
изучению реакции Белоусова-Жаботинского посвящены сотни работ, так как она дает
возможность на простой химической системе наблюдать особенности сложных
процессов самоорганизации и допускает различного типа управление, в том числе с
помощью различных режимов освещения (Мюллер, Зыков,
1998)
Упрощенная схема реакции представлена на рис.
13.
 |
Рис. 13. Схема реакции Белоусова –
Жаботинского. |
В случае хорошего перемешивания в некоторой области начальных концентраций
наблюдаются колебания окраски раствора, вызванные колебаниями концентрации Се4+. Колебания Се4+ - релаксацинные, период четко делится на две
части - T1 - фаза нарастания и T2 - фаза спада.
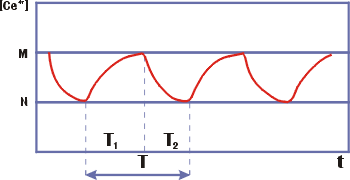 |
Рис. 14. Колебания в модели
Жаботинского ( |
Механизм реакции весьма сложен с химической точки зрения и содержит десятки промежуточных стадий. Основные стадии:


Продукты восстановления бромата, образующиеся на стадии 1, бромируют МК. Получающиеся бромпроизводные МК разрушаются с выделение Br-. Бромид является сильным ингибитором реакции.
Простейшая схема реакции:
Концентрация ионов церия Се4+ - x, концентрация автокатализатора - y,
концентрация бромида - z.
Кинетические уравнения, учитывая иерархию констант скоростей реакции и после
введения безразмерных переменных, приходим к системе двух уравнений для
концентраций ионов церия и автокатализатора x: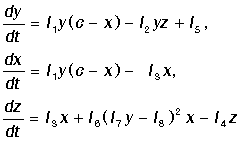
принимая во внимание временную иерархию констант реакций, дифференциальное
уравнение для z может быть заменено алгебраическим, и при
введении двух безразмерных переменных превратится в систему двух уравнений:
В литературе модель 'орегонатор', предложенная Field, Koros и Noyes (1972) встречается наиболее часто. Как
частный случай, модель
используется чаще всего. Малые параметры e и d отражают соответствующую структуру времен
процессов, а x соответствует безразмерной концентрации
HBrO2; y - Br-; z -
Сe4+.
Для изучения пространственно-временных процессов часто используется модель,
описывающая пространственно-временную динамику HBrO2 (переменная u) и
катализатора Сe4+ (переменная v):
Дополнительная информация:
© 2001-2026 Кафедра биофизики МГУ